
В погоне за созданием искусственных клеток из неживых компонентов учёные из Центра молекулярной биологии Гейдельбергского университета (ZMBH) преодолели ключевой барьер. Используя метод РНК-оригами, команда синтезировала нанотрубки, способные складываться в структуры, аналогичные цитоскелету живых клеток. Это достижение приближает науку к разработке полноценных синтетических клеток, способных функционировать без традиционного белкового синтеза.
Цитоскелет — важнейшая структурная система клеток, отвечающая за их стабильность, форму и подвижность. Однако создание таких элементов в искусственных условиях долгое время оставалось сложной задачей из-за зависимости от белков, которые формируются в ходе транскрипции и трансляции генетической информации. «Только в этом процессе задействовано более 150 генов», — подчёркивает профессор Гёпфрих, возглавляющая группу «Биофизическая инженерия жизни» в ZMBH.
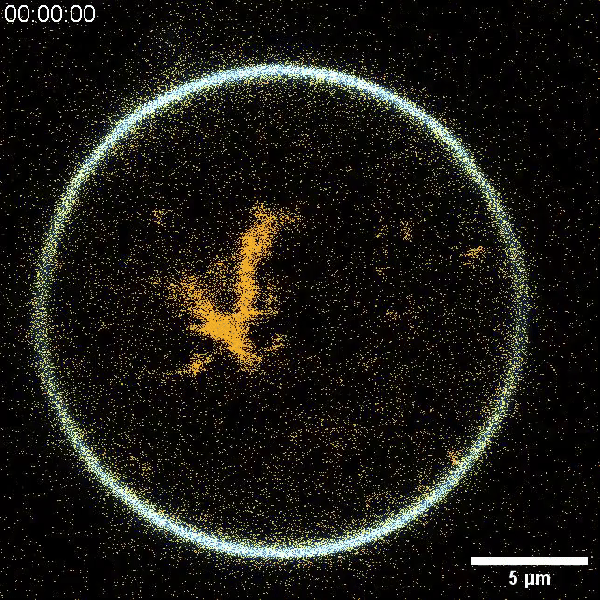
Чтобы обойти необходимость белкового синтеза, команда использовала РНК-оригами — технологию, которая позволяет создавать сложные структуры за счёт самоорганизации молекул рибонуклеиновой кислоты. Первым этапом стала разработка ДНК-последовательности с помощью компьютерного моделирования. Этот шаблон кодирует форму, которую РНК должна принять после сворачивания. Далее искусственный ген синтезировали и обработали с помощью РНК-полимеразы — фермента, который «считывает» информацию и производит соответствующий РНК-компонент. Специально созданные алгоритмы обеспечили корректное сворачивание молекул.
В результате исследователям удалось получить микротрубки длиной в несколько микрон, формирующие сеть, напоминающую естественный цитоскелет. Эксперименты проводились в липидных везикулах — упрощённых моделях клеток. С помощью РНК-аптамеров искусственные структуры прикрепили к мембранам. Учёные также показали, что свойства «скелета» можно регулировать, внося точечные мутации в ДНК-шаблон.
«В отличие от ДНК-оригами, РНК-оригами позволяет синтетическим клеткам самостоятельно производить строительные элементы», — отмечает Гёпфрих. Это открывает путь к направленной эволюции таких систем. По её словам, работа закладывает основу для разработки полной молекулярной «машинерии» РНК-клеток. Долгосрочная цель проекта — создать функциональные синтетические клетки, способные воспроизводиться и адаптироваться без участия природных белков.
Дальнейшие эксперименты позволят расширить функционал РНК-структур и приблизиться к созданию полностью автономных искусственных клеток, что может кардинально изменить биотехнологии и медицину.
-
Это суперкомпьютер Nvidia в формате мини-ПК с ценой 4000 долларов. Представлен DGX Spark

19.03.2025 21:39:00 | iXBT.com
Международная команда астрофизиков впервые вычислила изначальную массу нейтронных звёзд
19.03.2025 21:34:00 | iXBT.com
Nvidia неожиданно снизила рекомендованные цены на видеокарты GeForce RTX 50. Правда, только в Европе и вовсе не из-за проблем с продажами
19.03.2025 21:28:00 | iXBT.com
Новая теория объясняет плоскую геометрию Вселенной, тёмную энергию и инфляцию через запутанность с анти-двойником
19.03.2025 21:06:00 | iXBT.com
FAA провело экологическую оценку: SpaceX сможет удвоить число запусков с мыса Канаверал, но столкнулась с ограничениями из-за защиты редких видов
19.03.2025 20:18:00 | iXBT.com
Глубокое обучение помогло идентифицировать «пузыри» Млечного Пути, связанные со взрывами сверхновых
19.03.2025 19:41:00 | iXBT.com
Отечественный 200-сильный рамный внедорожник с корнями Toyota создали с учётом вкусов россиян. Sollers раскрыла подробности о новинке
19.03.2025 19:25:00 | iXBT.com
Сверхкритическая вода ведёт себя как газ: учёные опровергли миф о её структуре
19.03.2025 19:18:00 | iXBT.com
Квантовая механика заменила сингулярность чёрной дыры «началом» белой дыры
19.03.2025 18:26:00 | iXBT.com
Кроссоверы Xcite, выпускавшиеся на бывшем российском заводе Nissan, уходят с рынка: дилеры распродают машины со скидками более 500 тыс. рублей
19.03.2025 18:25:00 | iXBT.com
Обновленный дизайн и повышенная мощность: рассекречен рестайлинговый бюджетный Volkswagen Lamando L
19.03.2025 18:15:00 | iXBT.com
Крупнейшая сделка в истории Google и кибербезопасности: покупка Wiz за $32 млрд попадёт под антимонопольный контроль
19.03.2025 17:51:00 | iXBT.com
5100 мАч, экран 6,3 дюйма, IP68, 7 лет обновлений и топовый процессор Tensor G4. Представлен бюджетный Google Pixel 9a, и он дешевле iPhone 16e
19.03.2025 17:44:00 | iXBT.com
Губительное излучение чёрных дыр может оказаться ключевым фактором защиты жизни в галактиках спирального типа
19.03.2025 17:20:00 | iXBT.com
279 л.с., 8-ступенчатый «автомат», полный привод и 2 года гарантии. В Россию привезли Lexus RX 350 2025 в исполнении Premium Plus
19.03.2025 17:14:00 | iXBT.com
Российские операторы заменяют оборудование из Поднебесной на «отечественное», но по факту оно на 80% китайское
19.03.2025 17:12:00 | iXBT.com
C 2022 россияне купили больше 14 тыс. автомобилей Voyah, 76% из них — кроссовер Voyah Free
19.03.2025 16:46:00 | iXBT.com
Большой полноприводный кроссовер Volkswagen Tavendor 2025 в России подешевел уже на 1,3 млн рублей с начала года
19.03.2025 16:46:00 | iXBT.com
В России начали продавать Mazda CX-50 2025 года выпуска — 4,55 млн рублей, но возможны скидки
19.03.2025 16:34:00 | iXBT.com
Samsung выпустила важное обновление для Galaxy S22, Galaxy S22 Plus, Galaxy S22 Ultra, а также Galaxy S21 FE и Galaxy S24 FE
19.03.2025 16:07:00 | iXBT.com
Спектральный анализ связал околоземный Фаэтон с семейством астероида Паллады, открыв путь к изучению состава без дальних миссий
19.03.2025 16:05:00 | iXBT.com
Toyota RAV4 2025 подешевел в России на 340 тыс. рублей, в продаже появились полноприводные гибриды
19.03.2025 15:51:00 | iXBT.com
HP внедрила квантово-устойчивую криптографию в новые бизнес-принтеры для защиты от будущих атак
19.03.2025 15:29:00 | iXBT.com
500 гравитационных линз и 380 тысяч галактик: первый каталог телескопа Euclid обещает прорыв в изучении темной материи
19.03.2025 15:18:00 | iXBT.com
Синтетическая паутина и робот-паук помогли расшифровать механизм охоты пауков
19.03.2025 15:17:00 | iXBT.com
Такое бывает раз в 8 лет: в марте 2025 года россияне смогут наблюдать Венеру дважды в сутки
19.03.2025 14:56:00 | iXBT.com
Потеря атмосферы и миграция к звёздам оказались ключевыми факторами снижения числа субнептунов в старых системах
19.03.2025 14:51:00 | iXBT.com
Chery расширила линейку Tiggo 4 2025 в России. Названы актуальные цены
19.03.2025 14:41:00 | iXBT.com
В России официально заработал бывший завод Bridgestone: в этом году планируют выпустить 1,2 млн шин Cordiant и Gislaved
19.03.2025 14:31:00 | iXBT.com
Россия и Тунис могут организовать совместные пилотируемые космические миссии
19.03.2025 14:28:00 | iXBT.com
«Микромолнии» в брызгах воды могли запустить химическую эволюцию на ранней Земле
19.03.2025 14:24:00 | iXBT.com
Создана батарея, работающая на ядерных отходах и имеющая неограниченный срок службы
19.03.2025 14:23:00 | iXBT.com
-
В бывшем цехе «Кухни на районе» начали выпускать еду под брендом компании ресторатора Антона Пинского
28.07.2025 12:39:36 | vc.ru
Хакерские группы Silent Crow и «Киберпартизаны BY» заявили о причастности к сбою систем «Аэрофлота» — в авиакомпании и госведомствах информацию не комментировали
28.07.2025 12:10:33 | vc.ru
Anker отказалась от производства 3D-принтеров, оставив людей без запчастей
28.07.2025 12:00:34 | ferra.ru
Российские ученые разработали сверхпластичный бетон для сложных конструкций
28.07.2025 11:47:02 | ferra.ru
Операторы обсуждают с Минцифры возможность сохранять доступ к отдельным сервисам во время отключений интернета — Forbes
28.07.2025 11:36:14 | vc.ru
Samsung заключила с Tesla сделку на поставку чипов на $16,5 млрд до 2033 года
28.07.2025 11:13:22 | vc.ru
Новосибирские ученые создали антистатический материал для защиты от взрывов
28.07.2025 11:02:37 | ferra.ru
«Ростелеком» запустил витрину с играми и возможностью пополнения Steam
28.07.2025 10:36:41 | it-world
«Инвестпривлекательность отрасли не самая высокая»: глава «Роскосмоса» — о сотрудничестве с частным бизнесом, конкуренции с Китаем и США и перспективах полёта на Марс
28.07.2025 10:16:03 | vc.ru
«Глонасс» выводит на рынок первый российский сим-чип для транспорта и дронов
28.07.2025 09:44:02 | it-world
Глава ComEd призывает к регулированию ИИ, чтобы предотвратить рост счетов за электроэнергию
28.07.2025 09:38:11 | it-world
Лучшие приправы для макарон: простые добавки, которые превращают гарнир в блюдо — читать на Gastronom.ru
28.07.2025 09:11:00 | ГАСТРОНОМЪ
Клубничный мохито в домашних условиях, пошаговый рецепт с фото на 224 ккал
28.07.2025 09:10:00 | ГАСТРОНОМЪ
Смартфон Oppo Reno14 FS утёк в сеть: характеристики, фото и цена до анонса
28.07.2025 09:00:25 | ferra.ru
Можно ли повторно кипятить воду в чайнике? Вот что показал эксперимент — читать на Gastronom.ru
28.07.2025 09:00:00 | ГАСТРОНОМЪ
Лиса Алиса и Кот Базилио на стартап-охоте. Как масштабировать B2B продажи?
28.07.2025 08:53:53 | Хабр
Техническая поддержка проекта ВсеТут







