
Между самостоятельным организмом и клеточной «деталью» есть эволюционный мост — и исследователи из Университета Генриха Гейне в Дюссельдорфе нашли ключевое звено в этом процессе.
Изучая одноклеточных простейших жгутиконосцев Angomonas deanei, команда профессора Евы Новак обнаружила, как бактерии, поглощённые клеткой, превращаются в управляемые органеллы. Это открытие не только раскрывает тайну происхождения митохондрий, но и приближает эру синтетической биологии, где искусственные симбионты смогут выполнять запрограммированные функции внутри клеток.
Около 40–120 миллионов лет назад предки современных Strigomonadinae (подсемейство одноклеточных жгутиковых организмов) поглотили протеобактерию, которая со временем стала их эндосимбионтом — постоянным «поставщиком» метаболитов и кофакторов, критичных для выживания клетки. Сегодня этот симбионт, встроенный в организм жгутиконосцев, больше напоминает биологический чип, чем самостоятельный микроорганизм: он лишился почти всех генов, отвечающих за деление, и синхронизирует свой цикл с хозяином. Исследователи выяснили, что контроль над процессом взял на себя белок ETP9, вырабатываемый клеткой-хозяином.
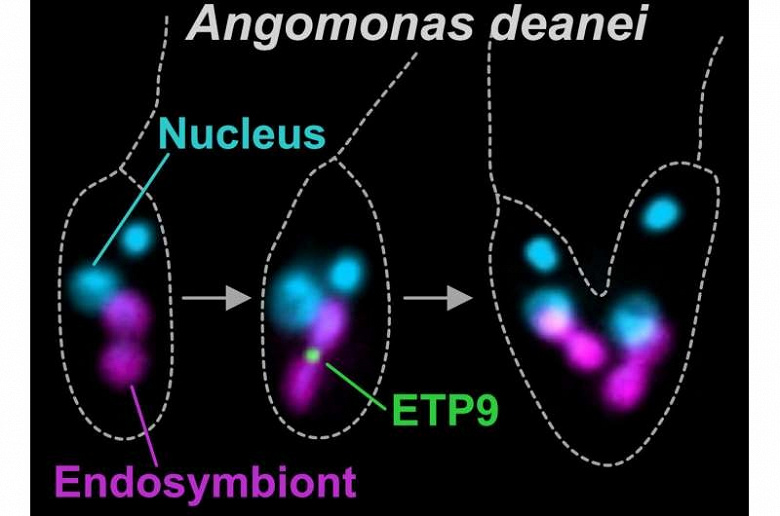
Раньше эндосимбионт делился самостоятельно, используя бактериальный белок FtsZ, который отмечает точку разделения. Однако сейчас, как показали эксперименты, без ETP9 этот механизм даёт сбой: вместо деления образуются вытянутые структуры со множеством неработающих «меток» FtsZ. Это похоже на попытку запустить двигатель без стартера — даже при наличии топлива система не активируется. Утратив генетическую автономию, симбионт стал зависим от команд, поступающих из ядра клетки.
«Мы наблюдаем промежуточный этап эволюции, — говорит ведущий автор исследования, профессор Ева Новак. — Эндосимбионт Angomonas deanei уже не бактерия, но ещё не полноценная органелла. Он сохранил лишь остатки исходного механизма деления, который теперь регулируется хозяином». Это открытие объясняет, как митохондрии, произошедшие от бактерий миллиарды лет назад, стали «энергостанциями» эукариотических клеток.
Практическое значение работы выходит за рамки эволюционной биологии. Понимание механизма контроля над симбионтами открывает путь к созданию искусственных аналогов — например, бактерий, которые можно интегрировать в клетки для производства лекарств или утилизации токсинов. Синтетические эндосимбионты смогут выполнять задачи, закодированные в их ДНК, но управляемые извне.
Сейчас команда Новак совместно с микробиологами и специалистами по визуализации изучает молекулярные взаимодействия между ETP9 и FtsZ. В перспективе это может привести к разработке методов «перепрошивки» симбионтов для целевой доставки препаратов или восстановления тканей. Такие технологии позволят создать гибридные биосистемы, где искусственные компоненты работают в тандеме с естественными процессами клетки — как когда-то протеобактерия начала свой путь от независимого организма до части живых существ.
-
У Lada Iskra возникли проблемы с безопасностью — опасный дефект связан со срабатыванием фронтальной подушки безопасности

20.03.2025 19:33:00 | iXBT.com
Huawei переизобрела «раскладушку». Представлен складной смартфон Huawei Pura X с 6,3-дюймовым экраном 16:10, 66-ваттной зарядкой, мощной камерой и защитой от воды
20.03.2025 18:32:00 | iXBT.com
АвтоВАЗ: производство российского флагмана Lada Aura идёт по графику, оно не сократилось
20.03.2025 18:10:00 | iXBT.com
«Кузов из фольги сделан? Вот раньше были кузова!». На критику Lada ответили на заводе АвтоВАЗ, раскрыв интересные детали производства
20.03.2025 17:11:00 | iXBT.com
Toyota Alphard, подвинься. В России начали продавать Volkswagen Multivan T7 2025, цена — 12,1 млн рублей
20.03.2025 17:03:00 | iXBT.com
Астрономы обнаружили кислород в самой далёкой галактике JADES-GS-z14-0, изменив представления о ранней Вселенной
20.03.2025 16:58:00 | iXBT.com
Теперь можно и купить: флагманский iPhone 16 Pro Max подешевел в России ровно вдвое с момента выхода
20.03.2025 16:49:00 | iXBT.com
Kia Sportage со 160-сильным мотором и «автоматом» подешевел в России на 240 тыс. рублей всего за месяц. Теперь цена стартует от 2,45 млн рублей — он дешевле Lada Aura
20.03.2025 16:49:00 | iXBT.com
Миннесотский университет раскрыл загадку: метеорит NWA 15915, найденный в 2023 году, оказался осколком древней разрушенной планеты
20.03.2025 16:28:00 | iXBT.com
Российские кроссоверы Xcite уходят с рынка через год после запуска, но люди будут платить кредиты ещё несколько лет: дилер рассказал, что 90% проданных машин — кредитные
20.03.2025 16:23:00 | iXBT.com
Представлен кроссовер Mitsubishi с расходом 4,1 л/100 км: Mitsubishi X-Force получил гибридную систему
20.03.2025 16:13:00 | iXBT.com
Представлена Honda Accord 2025 Sport — машину сразу предложили со скидкой в 8500 долларов
20.03.2025 15:54:00 | iXBT.com
Необычный смартфон Oukitel WP200 Pro несет в себе беспроводной наушник и смарт-часы
20.03.2025 15:51:09 | TechCult.ru
Spaceo и ESA объединили усилия: началась работа над надувным космическим парусом SWIFT, который выведет спутники с орбиты в 10 раз быстрее
20.03.2025 15:13:00 | iXBT.com
Китай возродил идеи СССР: ученые, опираясь на "Топаз-II", переосмыслили лунный реактор NASA, увеличив его мощность и срок службы
20.03.2025 15:07:00 | iXBT.com
Революция в материаловедении: созданы двумерные металлы толщиной в один атом
20.03.2025 14:59:00 | iXBT.com
Безопасность и стабильность Рунета: Роскомнадзор исследует зависимость от зарубежных серверов
20.03.2025 14:47:00 | iXBT.com
Lada Iskra в цветах российского триколора выставили в Сочи. Задержки массового производства не будет
20.03.2025 14:30:00 | iXBT.com
Первый большой кроссовер Dacia гораздо дешевле Kia Sportage и Toyota RAV4 вызвал ажиотаж: за Bigster уже выстроилась многотысячная очередь
20.03.2025 14:00:00 | iXBT.com
Chevrolet Cobalt — это самый продаваемый новый автомобиль в Казахстане. Продажи Chevrolet выросли почти вдвое за последний год
20.03.2025 13:34:00 | iXBT.com
Новые Renault Sandero Stepway от «АвтоВАЗа» всё ещё в продаже: цены стартуют от 1,69 млн рублей
20.03.2025 13:31:00 | iXBT.com
Пока Li Auto не выпустили на российский рынок, у нас официально выходит аналог Li L9 с гарантией. Уже в апреле стартуют продажи Aito M8
20.03.2025 13:09:00 | iXBT.com
Получить синюю галочку станет проще: «ВКонтакте» упростит процесс верификации
20.03.2025 12:57:00 | iXBT.com
Корейские ученые совершили прорыв: представлен новый метод производства мощных магнитов без редкоземельных элементов
20.03.2025 12:55:00 | iXBT.com
От протопланетных дисков до газовых гигантов: данные телескопа Kepler говорят о том, что у больших и малых планет разные пути формирования
20.03.2025 12:55:00 | iXBT.com
Панорама Москвы из редкоземельных металлов и Биг-Бен с настоящими часами: в России выпустили необычный iPhone 16 Pro
20.03.2025 12:48:00 | iXBT.com
Российский оператор T2 заработал в Ставропольском крае — до конца года бесплатно
20.03.2025 12:31:00 | iXBT.com
Ракеты будут летать в космос по расписанию — как ходят поезда. Электромагнитная катапульта позволит запускать ракеты Ceres-2 с высокой частотой
20.03.2025 12:26:00 | iXBT.com
Теперь не только очень мощно, но и дорого-богато. Представлен Zeekr 009 Brilliant Black Gold Edition: 789 л.с., полный привод и «золото»
20.03.2025 12:21:00 | iXBT.com
Четвёртое измерение света — наноплёнки научились управлять фотонами за доли секунды
20.03.2025 12:19:00 | iXBT.com
-
В Китае создали человекоподобного робота, дешевле двух Apple Vision Pro
27.07.2025 23:15:22 | ferra.ru
Трамп объявил о заключении торговой сделки с ЕС — она позволит европейским странам избежать 30-процентных пошлин
27.07.2025 21:31:03 | vc.ru
В новых утечках показали не только Pixel 10, но и Watch 4 и Buds Pro 2
27.07.2025 20:15:15 | ferra.ru
«Ночи у нас бессонные»: 43-летний Иван Стебунов впервые стал отцом
27.07.2025 20:00:10 | КИНО-ТЕАТР.РУ
Meta* нашла себе главного научного сотрудника нового подразделения ИИ
27.07.2025 19:30:09 | ferra.ru
Не ешь — подумай! «Фантастическая четверка: Первые шаги» — супергеройское резиновое изделие №37
27.07.2025 19:15:10 | КИНО-ТЕАТР.РУ
Принцесса, мечтающая стать футболисткой: Шарлотта на финале женского ЕВРО 2025
27.07.2025 19:00:00 | Woman.ru
"Уральские авиалинии" начнут выполнять рейсы из Екатеринбурга в Геленджик
27.07.2025 18:55:22 | Travel.ru
Настройка кастомного декодера для PostgreSQL и редактирование декодера auditd в Wazuh
27.07.2025 18:49:06 | Хабр
Новую RTX 5050 сравнили по производительности с Radeon RX 9060 XT 8 ГБ
27.07.2025 18:45:34 | ferra.ru
Нейролис, воскресшие в Висконсине и сибирские панки: главные трейлеры за неделю
27.07.2025 18:30:10 | КИНО-ТЕАТР.РУ
«Восставшего из ада» Клайва Баркера перенесут в игровое пространство
27.07.2025 17:45:10 | КИНО-ТЕАТР.РУ
Минификация кода для повышения эффективности LLM: влияние на лингвистику, генерацию и анализ программ
27.07.2025 17:35:13 | Хабр
Гогунский пытается оправдаться после скандалов: «Отключается сознание»
27.07.2025 17:30:00 | Woman.ru
Вульгарные позы и хорошие охваты: Саша Бортич опубликовала провокационную фотосессию
27.07.2025 17:00:10 | КИНО-ТЕАТР.РУ
Аспирин и другие популярные лекарства, которые нарушат ваш баланс веществ в организме
27.07.2025 16:30:54 | ferra.ru
IT-Weekly: штрафы за поиск экстремистского контента и расчеты в криптовалюте; ключевая ставка 18%
27.07.2025 16:29:02 | it-world
Haier показала гуманоидного робота на платформе с колёсиками для выполнения домашних дел
27.07.2025 16:22:22 | vc.ru
Техническая поддержка проекта ВсеТут




